Относительная молекулярная и атомная массы. Постоянная Авогадро. Количество вещества.
Размеры молекул и атомов чрезвычайно малы. Приведем несколько фактов:
- Молекула меньше яблоко в столько раз, во сколько раз яблоко меньше Земли.Если представить, что масло создает на поверхности воды пленку толщиной в одну молекулу, то такая пленка будет тоньше человеческого волоса примерно в 40 000 раз.
- В 1 см
 воздуха столько молекул, что, взяв такое же количество песчинок, можно было бы засыпать территорию крупного предприятия.
воздуха столько молекул, что, взяв такое же количество песчинок, можно было бы засыпать территорию крупного предприятия. - Если взять такое количество кирпичей, сколько молекул содержится в 1 см
 воздуха, то кирпичи б плотно покрыли поверхность Земли слоем высотой 120 м (высота 40-этажного дома).
воздуха, то кирпичи б плотно покрыли поверхность Земли слоем высотой 120 м (высота 40-этажного дома). - В капле воды диаметром 0,1 мм примерно
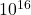 молекул, что почти в миллион раз больше, чем людей, живущих на Земле.
молекул, что почти в миллион раз больше, чем людей, живущих на Земле.
Соответственно чрезвычайно малы и массы атомов и молекул, поэтому для решения задач молекулярной физики вместо собственно масс атомов и молекул используют их относительные величины, сравнивая массу атома или молекулы с 1/12 массы атома углерода. Такое сравнение было принято в 1961 году по предложению Д. Дальтона. Подобный выбор обусловлен тем, что Карбон входит в состав многих химических соединений. А множитель 1/12 введено для того, чтобы относительные атомные массы приближались к целых чисел.

Относительная молекулярная масса ![]() — это отношение массы молекулы к 1/12 части массы атома углерода:
— это отношение массы молекулы к 1/12 части массы атома углерода:
![]()
где ![]() — масса молекулы вещества,
— масса молекулы вещества, ![]() -масса атома углерода.
-масса атома углерода.
Относительная атомная масса ![]() — это отношение массы атома к 1/12 части массы атома углерода:
— это отношение массы атома к 1/12 части массы атома углерода:
![]()
![]() — масса молекулы вещества,
— масса молекулы вещества, ![]() -масса атома углерода.
-масса атома углерода.
Атомная единица массы (а. e. м.)
и маленькой массы молекул и атомов их массы часто измеряют не в единицах СИ — килограммах, а в атомных единицах массы (а. е. м.) — масса 1/12 части атома углерода ![]() .
.
| 1 а.е.м. = |
|---|
Количество вещества наиболее естественно было бы измерять числом атомов или молекул в теле. Но их число в макроскопическом теле настолько велико, что в расчетах используется не абсолютное, а относительное число молекул. В СИ количество вещества выражают в молях.
Молярная масса М равен отношению массы вещества ![]() количеству молей
количеству молей ![]() в ней:
в ней:
![]()
где ![]() — количество вещества.
— количество вещества.
Молем называется количество вещества, которое содержит столько же молекул (атомов), сколько их содержится в 12 г углерода.
Стала Авогадро (![]() ) — число атомов или молекул в 1 моле любого вещества:
) — число атомов или молекул в 1 моле любого вещества: ![]() моль
моль![]()
Согласно закону Авогадро 1 моль идеального газа занимает при нормальных условиях
![]()
объем ![]() м
м![]() моль
моль![]() .
.
Количество вещества (![]() ) равен отношению числа молекул (
) равен отношению числа молекул (![]() ) в данном теле к постоянной Авогадро (
) в данном теле к постоянной Авогадро (![]() ), то есть числу молекул в 1 моле вещества:
), то есть числу молекул в 1 моле вещества:
![]()
Единица количества вещества — 1 моль.
Масса одного моля вещества называется молярной массой: ![]() , или
, или ![]() кг/моль
кг/моль
Единица молярной массы — 1 кг/моль.
Масса молекулы (в кг) выражена через молярную массу: ![]()
Масса тела (в кг) выраженная через массу одной молекулы и число молекул:
![]()
Количество вещества (в молях) равен отношению массы вещества к его молярной массы:
![]()
